| Idioma : |
|
| Comunitat enciclopèdia |Enciclopèdia Respostes |Enviar pregunta |Coneixement de vocabulari |Pujar coneixement |
Reacció de substitució |
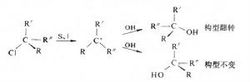   |
|
Substitució (reacció de substitució) es refereix a qualsevol molècula orgànica, un àtom o grup és el mateix tipus de reactiu o un grup d'altres àtoms se substitueixen per reacció representada per la fórmula: R-L (substrat de reacció) A ( reactiu ofensiu) → R-A (producte substituït) L (Gen d'esquerra). R = R o Ar Breu introducció Reacció de substitució nucleòfila es pot dividir en substitució, la substitució electrofílica i substitució homolítica, reacció concertada quatre categories. Si la reacció de substitució es produeix entre els grups dins de la molècula, anomenada intramolecular substitueix. Alguns reacció de substitució simultània i el canvi molecular (veure reacció de transposició).En química orgànica, la reacció de substitució electròfila i nucleòfila és molt important. La reacció de substitució dependrà següents característiques orgàniques, es classifiquen en diverses categories de reaccions orgàniques: Reactius per promoure el reactiu electrofílic és un nucleòfil. Un producte intermedi en la reacció és un catió, un anió o una reacció de radicals o dos passos es produeixen simultàniament. La reacció del substrat és un compost alifàtic o un compost aromàtic. Més informació sobre les categories no només és útil per predir el producte de reacció de resposta, i ens pot ajudar, com la temperatura, solvent, etc La reacció és variable, fins a l'optimització. Classificació reacció Substitució ① reacció de substitució nucleofílica Coneguda SN (S per l'anglès "Substitució" (reemplaçar), N és "nucleofílica" (nucleòfil), han pres la primera lletra majúscula). Saturada reacció de substitució nucleofílica de carboni en el lot. Per exemple, halurs d'alquil poden ser, respectivament, i l'hidròxid de sodi, alcòxid de sodi o fenóxido de sodi, tiourea, tiol, carboxilats de sodi i amoníac o amina, la reacció de substitució nucleòfila, un alcohol, èter, tiol, tioéter, àcid carboxílic èsters i amines. Àcids hidràcids halogenats amb l'alcohol, clorur de tionilo o halur de fòsfor, generant un hidrocarbur halogenat. Halón és la reducció de hidrur de liti i alumini d'alcans, també ions d'hidrogen negatius reemplacen halogen reactiu. Quan el reactiu nucleòfil és un àtom de carboni, un substituït que resulta en un enllaç carboni - carboni, per obtenir amb això un productes de la cadena de carboni, tals com halur d'alquil amb cianur de sodi, sodi o reaccions alquí enolat. En la reacció de substitució nucleòfila, C-X unir la primera pausa, la generació d'ions carboni parlen reactiu, per formar C-I de bons, aquesta reacció s'anomena reacció nucleòfila unimolecular, denotat per S N 1. C-X i l'escissió de l'enllaç C-I de bons reaccions de formació que tenen lloc simultàniament anomenat reacció de substitució nucleofílica bimolecular, denotat per S N 2. Com els reactius i condicions de reacció són diferents estructura, SN té dos mecanismes, és a dir una sola molècula de reacció de substitució nucleòfila SN1 i reacció de substitució nucleòfila bimolecular SN2. SN1 procés es divideix en dos passos: el primer pas, l'escissió de l'enllaç reactius (ionització) per formar ions carboni intermedi reactiu i un grup sortint, el segon pas, carbocatió ràpid amb un producte amb el reactiu. La velocitat de reacció global és només proporcional a la concentració dels reactius, i la concentració de reactiu. S N2 per al vell bons descans i nous bons es formen simultàniament procés col · laboratiu. La velocitat de reacció i les concentracions de reactius són proporcionals a la concentració del reactiu. Es pot generar ions carbenio relativament estables i la reacció del grup sortint SN1 propensos, l'àtom de carboni central dels reactius més petites estèricament impedit propensos SN2. Si nucleòfil alcalina, la reacció de substitució nucleòfila és acompanyat sovint per la reacció d'eliminació, depèn de la relació entre l'estructura de reactius naturalesa dels reactius i condicions de reacció. Les baixes temperatures i l'escassa alcalines substituir el SN beneficiós. Halocarbons reaccions de substitució nucleòfila inclouen les següents categories: (1) la hidròlisi. Aigua de reacció Halocarbon produeix alcohol anomenada reacció d'hidròlisi. La reacció és reversible: Rx HOH → ROH HX. En efecte, el valor de la reacció és generalment no preparat. La majoria dels hidrocarburs halogenats es preparen a partir del corresponent alcohol. Halocarbons No obstant això, ja que algunes molècules complexes que un grup hidroxil introduït en la introducció d'un àtom d'halogen difícil, així que de vegades també s'utilitza sintetitzats hidròlisi dels corresponents alcohols. En aquest cas, l'halur d'hidrocarbur s'utilitza sovint amb una solució aquosa d'hidròxid de potassi o de sodi de calor del sistema de Rx NaOH → ROH NaX. Reacció pot ser completa, a causa de OH-és més de X-nucleòfila, i l'halur d'hidrogen generat per neutralització alcalina. (2) reacció amb cianur de sodi. Els halocarbons i cianur de potassi en una solució d'alcohol o la reacció de nitril de sodi, síntesi orgànica, sovint necessiten per fer créixer la cadena de carboni, halocarbons i potassi (sodi) resposta de creixement és una forma d'un àtom de carboni. No obstant això, el potassi (sodi) és altament tòxic quan s'utilitza per a prestar una atenció especial. Per grup nitril (-CN) es pot sintetitzar àcid transició (-COOH) i els seus derivats. (3) amb el alcòxid de sodi, amoníac, la reacció de nitrat de plata, la reacció és la preparació dels dos primers mètodes d'èters i amines. Després d'una reacció sovint s'utilitza per a la identificació de halocarbons (veure més avall), però alguns no ho són halocarbono inert de reacció amb nitrat de plata, com ara Arx, RCH = CHX, HCCl3, ArCOCHCl i altres tipus d'halocarbonis ROCHCHCl hi ha tals reacció . (4) amb la resposta de fòsfor orgànic. Els halocarbons-tres alquilfosfatos paper de la sal de fosfoni, aquest últim sota l'acció de la ilur de fòsfor alcalí es perden protons (iluro) o fòsfor YE Li-anomenats perquè (ileno). RCHX RPRPCHRX que: X és I, Br, Cl, etc, R és llogo o aril. Fòsfor ilurs generalment més estables, però de vegades molt animat. Expressat en dos limitants de tipus ressonància. ② reacció de substitució aromàtica Per reacció de substitució electròfila aromàtica SEAr i Snar reacció de substitució nucleòfila aromàtica (S representa un substituït, N representa un nucleòfil, Ar representa un anell aromàtic) categories, Ar representa un grup aril. Hidrocarbur aromàtic a través de nitració, halogenació, sulfonació i alquilació o acilació, respectivament, en la introducció d'un grup nitro en l'anell aromàtic, un àtom d'halogen, un grup d'àcid sulfònic i un grup alquil o acil, aquests es consideren SEAr. Els substituents en el compost d'anell aromàtic ja, agent reactiu substituït ataquen un efecte de posicionament. El substituent en el grup fenil de l'anell donador d'electrons i un àtom d'halogen, més reactius electròfils en l'orto-i para; grup acceptor d'electrons substituent, m-producte obtingut principalment llocs. A més de l'aparició normal d'aquestes reaccions, de vegades reactius també poden atacar a la posició original del substituent i en el seu lloc, una condició coneguda com a substitució in situ. Snar certes condicions han de ser dut a terme. Tal com hidrocarburs halogenats aromàtics Snar generalment menys propensos, però per un àtom d'halogen orto o activació paràgraf nitro se substitueix fàcilment. Hidrocarburs aromàtics halogenats en condicions alcalines també pot ocórrer reemplaçat. A més, la sal de diazoni aromàtic com un grup sortint en una fractura estable nitrogen molecular, a favor de fenil d'ions positius generats, sinó també l'aparició de reaccions similars SNL. ③ reacció de substitució homolítica SH Short (S per l'anglès "Substitució" (reemplaçar)). És una resta dels àtoms reactius en un atac producte resultant molècula i una nova reaccions de radicals lliures. Aquesta reacció és generalment una reacció en cadena de l'etapa de transferència de cadena de radicals lliures. Alguns compostos orgànics es produeix de forma automàtica en l'oxidació amb aire, el procés és la substitució homolítica, com ara benzaldehid, tals com cumè i tetralina interactuen amb l'oxigen, respectivament generar el peròxid orgànic. Suma i reaccions de substitució distinció Definició reacció de substitució: molècules orgàniques en un àtom o grup d'àtoms per altres àtoms o grups d'àtoms se substitueixen reaccions. Tipus de comparació: Molts llibres de referència sovint comparar-lo amb la reacció de substitució, però crec que és més com la reacció de metàtesi. Exemple: a CH4 i Cl2 reacció, per exemple, el principi és: una H és un Cl substituït, és a dir, enllaç C-H esdevé C-Cl enllaç. El restant H-Cl i està substituït produir HCl. Caracteritzat per: una H està substituït, consumir una Cl2, per produir una HCl. Definició de reacció: les molècules orgàniques no saturades d'àtoms de carboni amb altres àtoms o grups d'àtoms units directament a una reacció per generar una nova substància. Tipus de comparació: els tipus des del punt de vista material, similar a la reacció de combinació. Exemple: CH2 = CH2 i Br2 en la reacció, per exemple, el principi és: C = enllaç doble C al desconnectats un, dos C cada forma un mitjà clau, respectivament, i amb dos Br Es caracteritza per un enllaç doble es converteix en un enllaç senzill, insaturat variablement saturat. |
| Usuari Revisió | Tots Revisió [ 1 ]>>> |
| ||||